我國的藥品專利鏈接要來了,仿制藥企業該如何應對
藥品研發具有周期長、投入高、風險大的特點,因此,需要借助相關制度的設計,對藥品研發的成果予以充分保護。其中,藥品專利補償制度和藥品專利鏈接制度的建立就是其中重要的一項。
藥品專利補償制度:為有價值的創新藥品專利提供保護期延長,可鼓勵創新藥研發。
藥品專利鏈接制度:對創新藥和仿制藥提供平衡保護,以鼓勵創新、鼓勵挑戰、激勵競爭。
自2017年以來,中共中央、國務院及藥監局多次發布文件,明確指出探索建立藥品專利鏈接制度和藥品專利補償制度。2020年7月3日,全國人大將《中華人民共和國專利法修正案(草案二次審議稿)》向社會公眾征求意見,涉及藥品專利為第十二和第二十七條款,意味著我國藥品專利補償制度和藥品鏈接制度即將落地。
本文通過比較研究各國相關藥品專利制度,分析我國的藥品專利補償制度和藥品鏈接制度的建立和實施進展。
01專利有效期延長,利于創新藥企業

(1)美國最先提出“藥品專利期補償”的概念。1984年的Hatch-Waxman法案規定:1、美國藥品專利到期最長可延長5年,但專利補償期和上市后剩余的專利期累計不能超過14年;2、一種藥物只能延長一個專利的保護期。

(2)歐洲以補充專利證書的形式實現藥品專利保護期的延長(SPC)。《歐洲專利公約》(簡稱EPC)第63條規定,當專利的客體是產品或產品制造方法、使用方法時,締約國可做出延長期限或相應保護的規定。
(3)日本的專利期延長制度主要借鑒美國,只是日本的專利補償制度的規定較為寬松。日本專利法第67條規定,允許藥品的多個專利多次延長,藥品上市后有效專利期不設置上限。
2017年10月《關于深化審評審批制度改革鼓勵藥品醫藥器械創新的意見》中首次明確提出對于因臨床試驗和審批延誤上市時間的藥品專利給予適當的專利期限補償。2019年1月公開的《專利法修正案(草案)》中提出對于在中國境內和境外同步申請上市的創新藥品發明專利,國務院可以給予專利期限延長。2020年7月公開的《專利法修正案(草案二次審議稿)》中則修改為對在中國獲批上市許可的新藥發明專利適當給予專利期限補償。
其中規定了兩種可以獲取專利補償的情形:
情形一:“自發明專利申請日期滿四年,且自實質審查請求之日起滿三年后授予發明專利權的,專利權人可以就發明專利在侵權過程中不合理延遲請求補償專利有效期”;
情形二:“為補償新藥上市審評審批占用時間,對在中國獲得上市許可的新藥發明專利,國務院專利行政部門可以應專利權人的請求給予期限補償”。
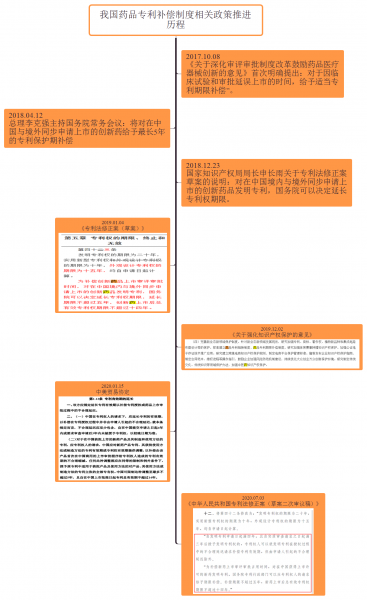
備注1:包括創新藥和改良型新藥
備注2:產品中的藥品定義為活性成分,包括物質單體,其鹽或酯,不包括其代謝物,單獨或與其他活性成分的組合
備注3:美國的藥品用途專利的保護范圍僅限于獲得FDA批準的適應癥;制備方法專利的保護范圍僅限于獲批的藥品的制備步驟,即被延長的權利要求保護范圍僅限于與FDA許可上市的藥品的有效成分,制備方法和用途相關的技術方案,而非授權權利要求保護范圍的整體。
比較分析各國專利補償制度的可知:
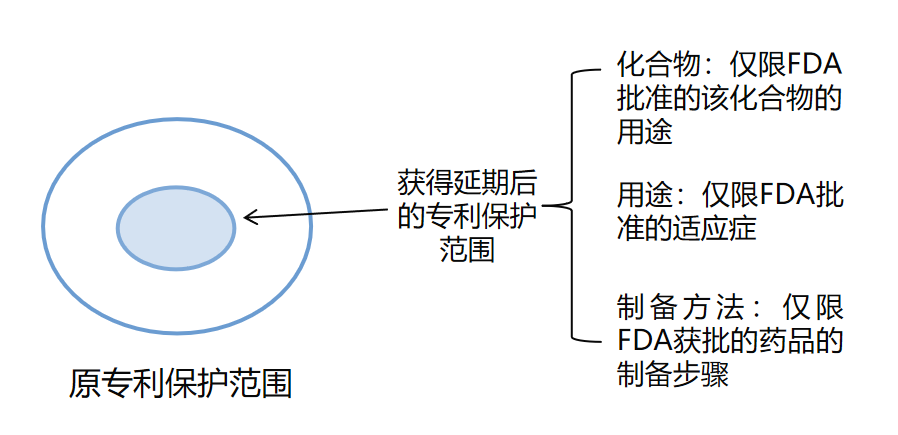
- (1)FDA批準的藥品專利有效期延長后的保護范圍小于原專利要求保護的范圍,如下圖所示:
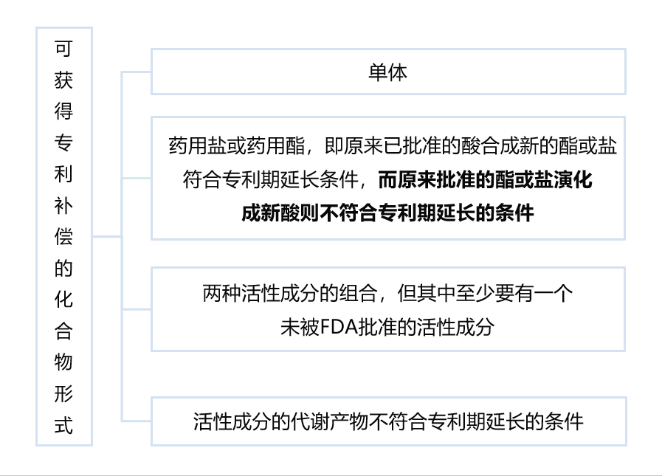
- (2)FDA對于可獲得專利期延長的藥品專利中的活性成分有特殊限定,如下所示:
- (3)日本藥品專利補償區別與歐美國家,同一藥品可獲得多次專利有效期補償
- (4)中國的藥品專利補償的期限(草案二)基本與美國的一致,但尚未明確補償期限的計算方法及可獲得補償的專利類型。中美貿易協定中則對于專利補償的類型給出明確規定:產品專利、方法專利及用途專利。
02專利糾紛早期解決的有效機制,藥品專利鏈接制度的建立
藥品專利鏈接,是指仿制藥上市批準與創新藥品專利期滿相“鏈接”,即仿制藥注冊申請應當考慮先行上市藥品的專利狀況,從而避免可能產生專利侵權。
藥品鏈接制度最早起源于美國,1984年,美國通過Hatch-Waxman法案,該法案中規定了藥品專利鏈接制度、藥品專利保護期補償、數據保護等內容。目前,加拿大、澳大利亞、韓國等國家通過與美國簽訂自由貿易協定,相繼引入了專利鏈接制度,歐盟、日本、印度尚未建立該制度。
2017年后我國開始逐步探索建立藥品專利鏈接制度,《專利法修正案(草案二次審議稿)》中明確規定了專利權人的起訴期、9個月訴訟期等內容,其建立的基本框架與美國一致,但很多地方仍需要進一步細化。
主要國家的藥品鏈接制度比較
備注1,美國生物類似物遵循美國的“Patent Dance”制度
備注2,原研企業在藥品獲得上市許可后30天內提出登記申請,藥品上市后授權的專利,在專利授權后30日內提出申請。藥品獲批之后授權的專利,僅限于藥品獲得上市日之前的專利,對于在藥品獲得上市審批之以后才提交申請的專利,則不能列入清單中
備注3,美國藥品鏈接制度的流程圖:
由上表分析,可知我國藥品鏈接制度具有以下特點:
- 《專利法修正案(草案二次審議稿)》中第27條第2款中規定“對技術審評通過的化學藥品上市許可申請,國務院藥品監督管理部門可以根據人民法院裁判或者國務院專利行政部門裁決,做出是否批準藥品上市的決定”,其明確了我國的藥品鏈接制度適用的藥品種類為“化學藥品”,不包含生物制劑、中藥等,這與美國藥品鏈接制度適用的范圍一致;
- 《專利法修正案(草案二次審議稿)》中第27條第1款中規定“專利權人或者利害關系人認為申請上市藥品的相關技術方案落入中國上市藥品專利信息登記平臺登載的相關專利權保護范圍的,可以自國務院藥品監督管理部門公示藥品上市許可申請之日起三十日內向人民法院提起訴訟或者向國務院專利行政部門申請行政裁決”。經查詢,目前未見有“中國上市藥品專利信息登記平臺”。有收錄藥品專利信息的為“中國上市藥品目錄集”平臺。美國專利信息登記在FDA橙皮書中。
- 《專利法修正案(草案二次審議稿)》中第27條第1款中規定“專利權人或者利害關系人認為申請上市藥品的相關技術方案落入中國上市藥品專利信息登記平臺登載的相關專利權保護范圍的,可以自國務院藥品監督管理部門公示藥品上市許可申請之日起三十日內向人民法院提起訴訟或者向國務院專利行政部門申請行政裁決”。可見,專利權人或者NDA持有人的起訴期為30日,但與美國不同的是,草案中并未規定仿制藥申請人主動通知專利權人或NDA持有人的義務,起訴期的起算時間點為自國務院藥品監督管理部門公示藥品上市許可申請之日起三十日內,可見,專利權人或NDA持有人對于藥監局公示的信息需要及時關注,才能及時發現潛在的侵權人;
- 《專利法修正案(草案二次審議稿)》中第27條第3款中規定“人民法院或者國務院專利行政部門自專利權人或者利害關系人請求受理之日起就九個月內作出生效裁決或者行政裁決的,對技術審評通過的化學藥品上市許可申請,國務院藥品監督管理部門可以根據人民法院裁決或者國務院專利行政部門行政裁決,做出是否批準藥品上市的決定”。美國的藥品鏈接制度規定專利權人或者利害關系人收到仿制藥申請人的通知后,如提起侵權訴訟,則仿制藥申請自動停止審批30個月,但不會停止審批。如果30個月內,專利權人勝訴,則仿制藥申請人的ANDA申請不會獲批;仿制藥企業勝訴,FDA會審批上市;30個月訴訟仍未解決,FDA會直接批準仿制藥上市。可見,與美國的鏈接制度相比,草案中規定了9個月的訴訟期,但未明確規定9個月訴訟未解決是否批準藥品上市的情形。此外,9個月的時間遠少于FDA規定的30個月,這也意味著專利權人不僅需要及時關注藥監局公示的藥品上市申請信息及時發現侵權人,而且需要及時提起訴訟或請求行政裁決,如果9個月未有結果的話,很有可能面臨藥監局對于仿制藥申請發出上市許可。此項條款的規定,也預示著未來國內專利挑戰的案例越來越多,創新藥企業和仿制藥企都需要過硬的專利分析水平。
綜上,我國的藥品專利補償制度和鏈接制度大多借鑒了國外經驗,相信隨著《專利法修正案(草案二次審議稿)》的公開,我國的藥品專利補償制度和鏈接制度會逐步實施,配套的司法規章和相關制度也會逐漸完善,最終會建立具有中國特色的有效的“銜接和鏈接”機制,進而有效的推進我國由制藥大國向制藥強國邁進。
關于我們:
綜合信息部由20名成員組成,其中總監1名、經理2名、主管1名、高級藥理專員1名、藥理專員15名,均來自北京大學、中國醫學科學院北京協和醫學院等國內外知名院校。綜合信息部主要負責公司的國際/國內項目立項、品種市場信息支持、公司知識產權維護及撰寫臨床/藥理相關申報材料,為公司研發提供信息保障。
部門下設5個中心,其中仿創藥立項策略中心主要負責仿制藥、創新藥品種立項;臨床&藥理中心負責相關申報材料撰寫;知識產權中心負責公司知識產權維護;大數據分析中心負責國內外品種信息分析、企業產品管線規劃及戰略合作伙伴個性化信息支持;國際新產品策略中心關注國際原料藥、裝置、制劑品種信息,提供中美、中歐雙報立項信息。
轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
