政策法規 || 《模型引導的創新藥物劑量探索和優化技術指導原則》(附法規概覽12.23-1.3)
01
國家藥監局藥審中心關于發布《模型引導的創新藥物劑量探索和優化技術指導原則》的通告(2024年第53號)
為推動創新藥物高質量發展,進一步指導我國創新藥物臨床試驗階段劑量探索和優化,藥審中心組織制定了《模型引導的創新藥物劑量探索和優化技術指導原則》(見附件)。根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,經國家藥品監督管理局審查同意,現予發布,自發布之日起施行。

掃描圖中二維碼
查看詳細信息

02
國家藥監局關于發布《藥品生產質量管理規范(2010年修訂)》藥用輔料附錄、藥包材附錄的公告(2025年第1號)
為貫徹落實《中華人民共和國藥品管理法》《中華人民共和國藥品管理法實施條例》《藥品注冊管理辦法》《藥品生產監督管理辦法》等有關規定,監督指導藥用輔料、藥包材生產企業規范生產,國家藥監局根據《藥品生產質量管理規范(2010年修訂)》第三百一十條規定,組織制定了藥用輔料附錄、藥包材附錄,作為《藥品生產質量管理規范(2010年修訂)》的配套文件,現予以發布(見附件1、2),并就加強藥用輔料、藥包材質量監管有關事項公告如下:

掃描圖中二維碼
查看詳細信息

03
關于公開征求《化學仿制藥參比制劑目錄(第九十批)》(征求意見稿)意見的通知

掃描圖中二維碼
查看詳細信息

04
關于發布《國家藥用輔料標準編寫細則(2025年版)》的通知
掃描圖中二維碼
查看詳細信息

01
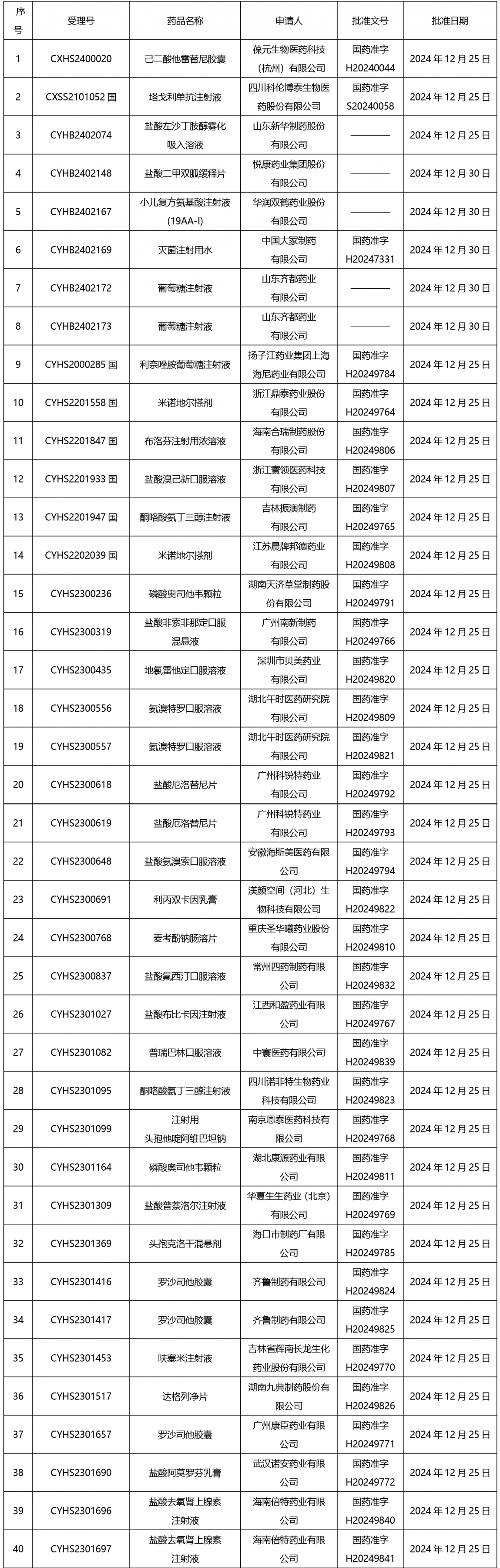
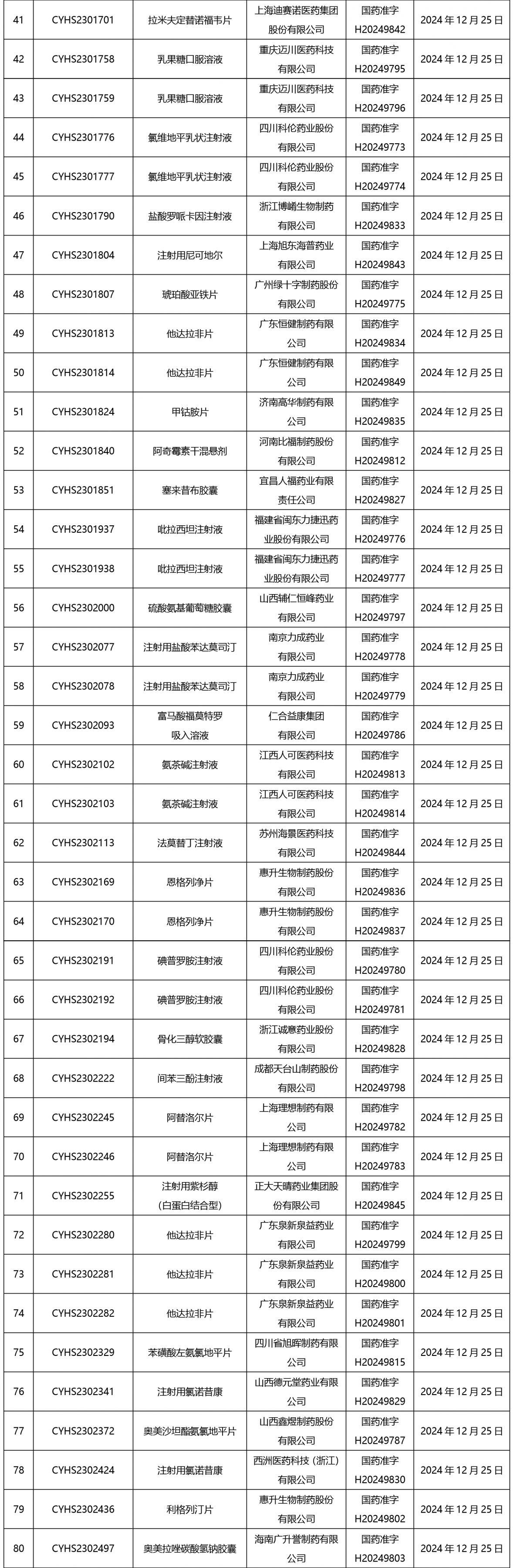
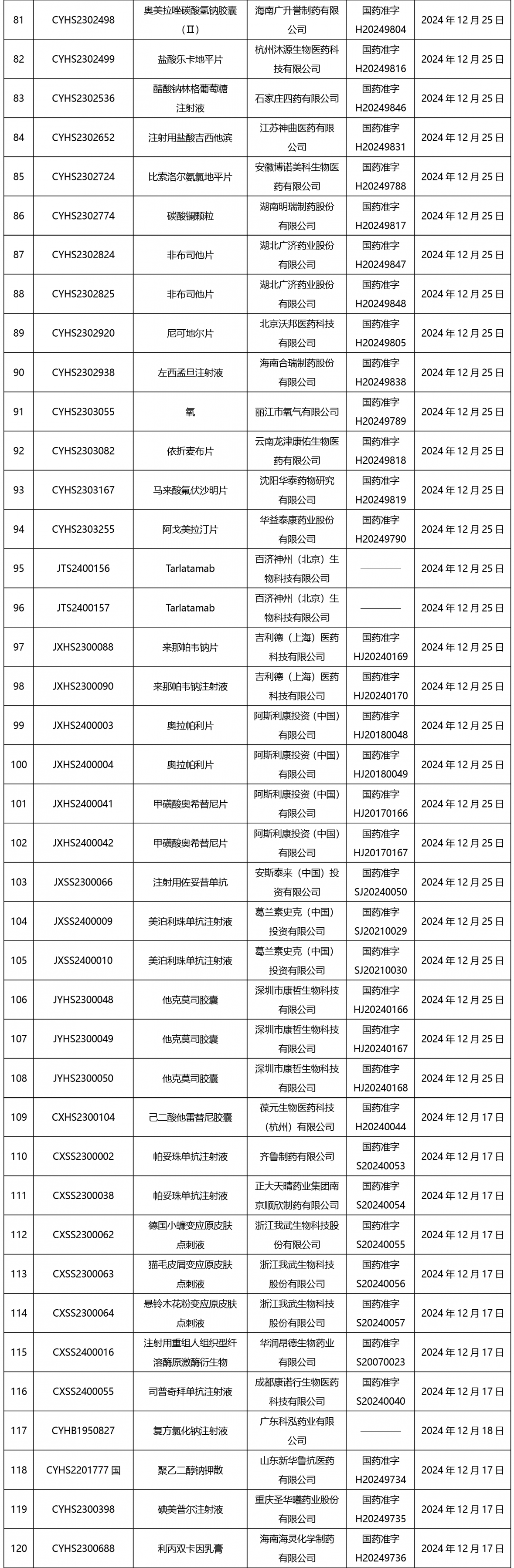
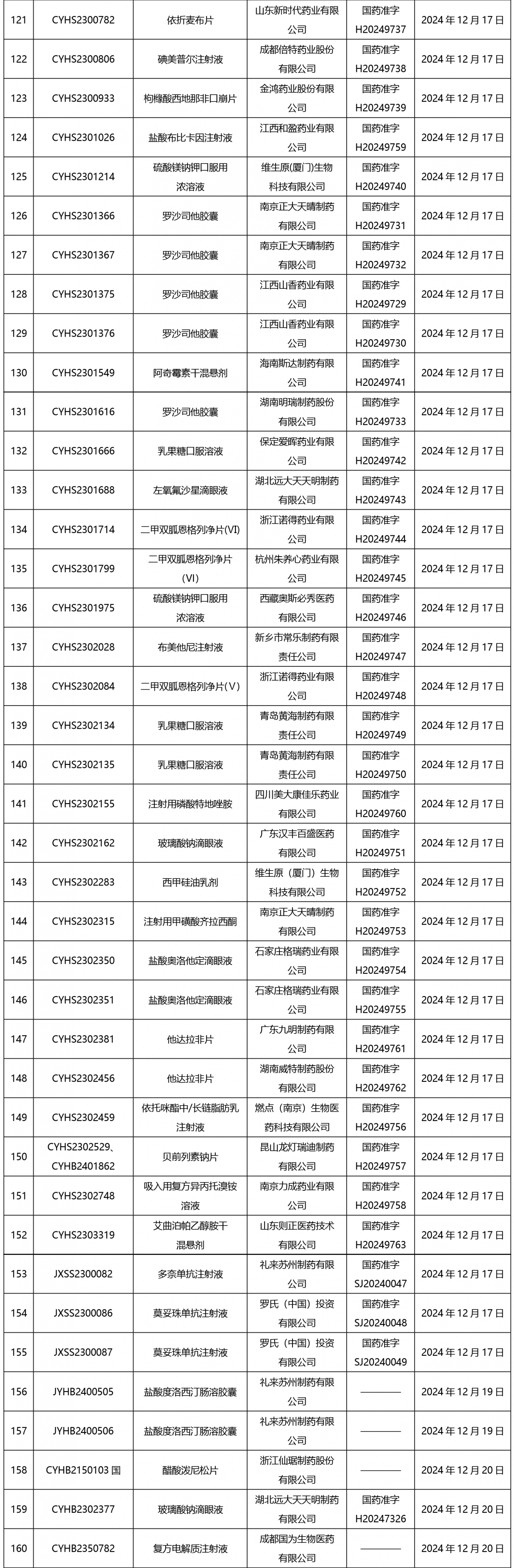
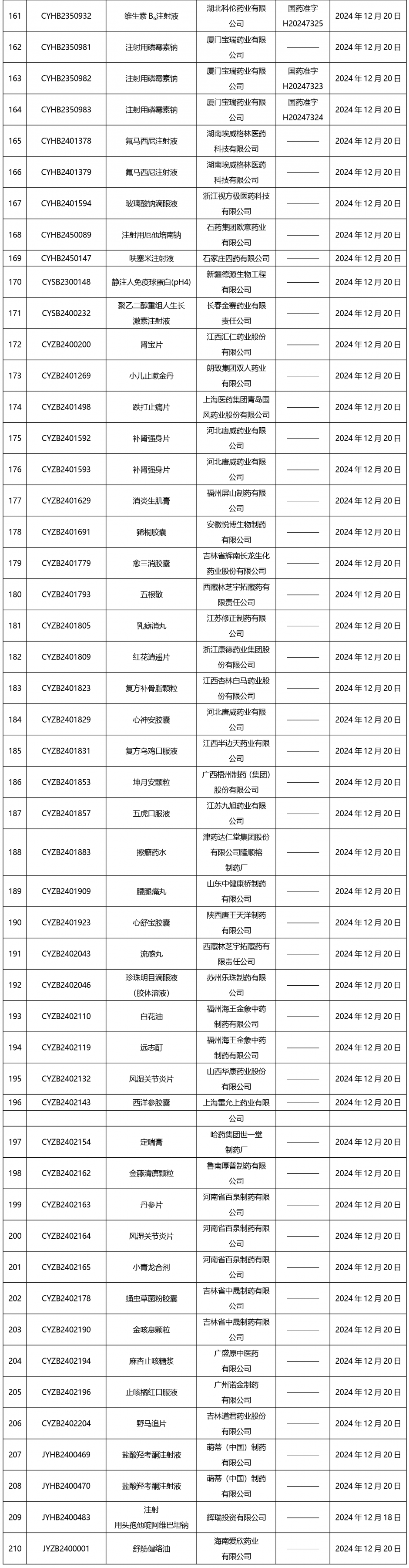
截止2025年1月3日17:00本周發布210個待領取藥品批準證明文件,其中注射劑67個,一致性評價品種9個。
02
國家藥監局關于枸櫞酸鉍鉀顆粒處方藥轉換為非處方藥的公告(2024年第155號)

掃描圖中二維碼
查看詳細信息

03
國家藥監局關于注銷顛茄磺芐啶片藥品注冊證書的公告(2025年第2號)

掃描圖中二維碼
查看詳細信息

01
關于公開征求《簡化港澳已上市傳統口服中成藥內地上市注冊審批申報資料及技術要求(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細信息

02
國家藥監局藥審中心關于發布《評價胰島素類藥物藥代和藥效動力學的正葡萄糖鉗夾試驗指導原則》的通告(2024年第56號)

掃描圖中二維碼
查看詳細信息

03
國家藥監局藥審中心關于發布《肽類藥物臨床藥理學研究技術指導原則》和《抗體類藥物臨床藥理學研究技術指導原則》的通告(2024年第55號)

掃描圖中二維碼
查看詳細信息

04
國家藥監局藥審中心關于發布《多糖結合疫苗藥學研究及評價技術指導原則(試行)》的通告(2024年第51號)

掃描圖中二維碼
查看詳細信息

05
國家藥監局藥審中心關于發布《疫苗臨床試驗統計學指導原則(試行)》的通告(2024年第52號)

掃描圖中二維碼
查看詳細信息

06
國家藥監局藥審中心關于發布《藥物臨床試驗樣本量估計指導原則(試行)》的通告(2024年第54號)

掃描圖中二維碼
查看詳細信息

01
關于藥品注冊申請人之窗聯通政務服務門戶的通知
掃描圖中二維碼
查看詳細信息

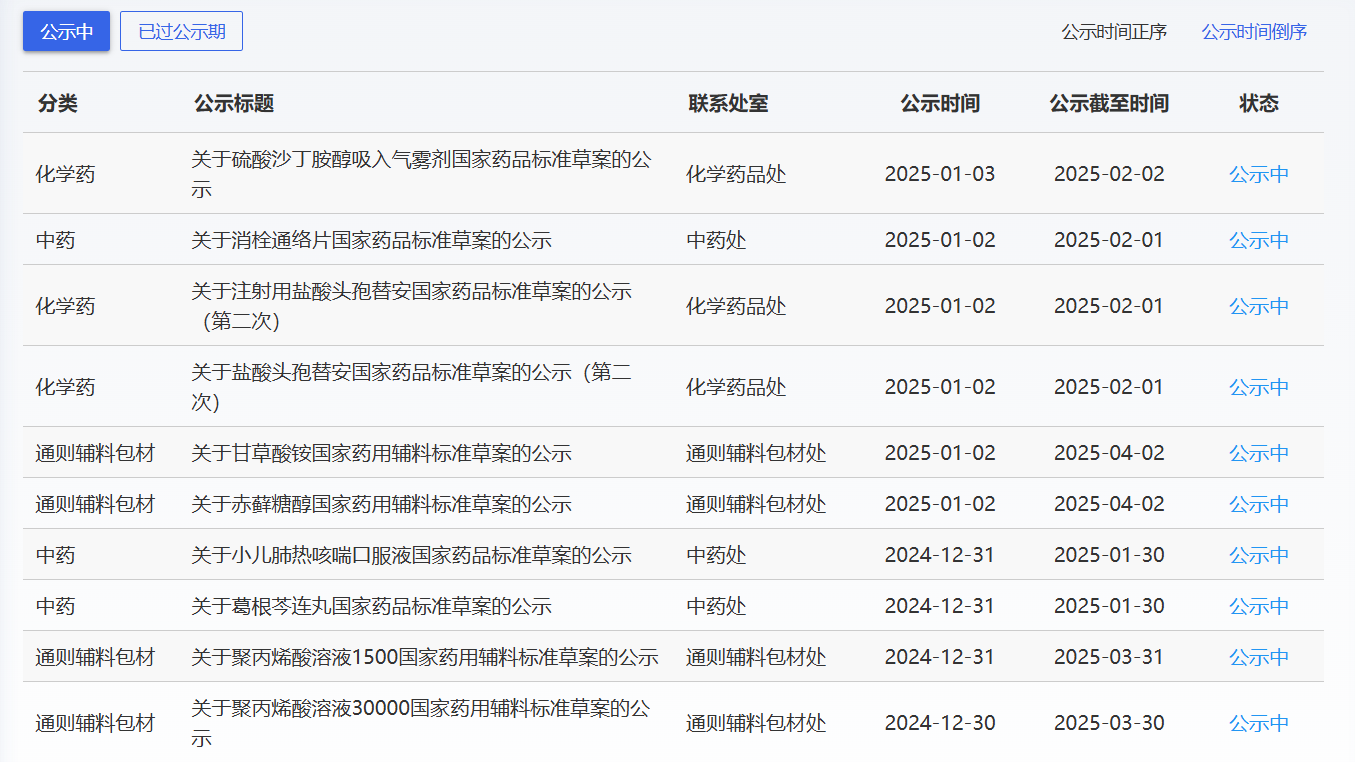
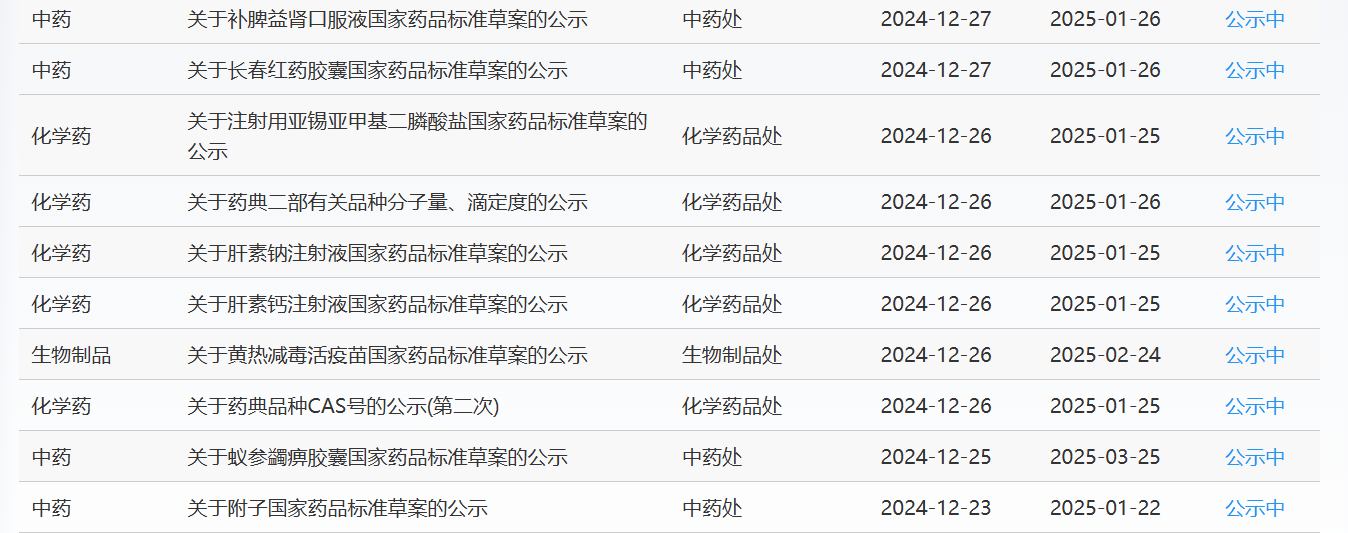
近期,藥典委發布的標準草案公示如下:

-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
